PREVENZIONE NELLE NEOPLASIE
L'articolo riportato di seguito nasce con la collaborazione di uno dei medici dentisti del nostro Centro Dentistico, dott. Massimiliano De Biase, con l'Ambulatorio di Patologia e Medicina Orale della Clinica Odontoiatrica e Stomatologica dell’Università degli Studi di Milano - Istituti Clinici di Perfezionamento.
Prevenzione delle lesioni orali displastiche
Il ruolo dell’igienista dentale
C. Batia, S. Batia
M. De Biase, *G. Farronato
F. Spadari
Università degli Studi di Milano Istituti Clinici di Perfezionamento ICP - Milano
Clinica Odontoiatrica e Stomatologica
Direttore: prof. F. Santoro Cattedra di Ortognatodonzia Titolare: prof. G. Farronato
*Ambulatorio di Patologia e Medicina orale
Titolare: prof. F. Spadari
Le precancerosi delle mucose del cavo orale rappresentano un campo della stomatologia ancora sottoposto a revisioni e a studi clinico-epidemiologici. A tutt’oggi sia l’inquadramento nosologico, sia le difficoltà cliniche e diagnostiche rendono le precancerosi orali un campo ancora arduo e di difficile approccio per i diversi specialisti delle svariate discipline medico-chirurgiche (odontostomatologo, otorinolaringoiatra, dermatologo ecc). L’igienista è molte volte la figura professionale che per prima, durante le manovre di profilassi, può richiamare l’attenzione dell’odontoiatra verso una lesione sospetta che si può ritenere potenzialmente maligna. Scopo del lavoro è quello di presentare sinteticamente gli aspetti clinici, istopatologici e preventivi delle precancerosi orali, in modo tale che l’igienista dentale possa essere in grado di “segnalare” la presenza di una lesione ritenuta “sospetta” all’odontoiatra. Con il termine di precancerosi si definisce uno stato clinico associato a un rischio di sviluppare un cancro significativamente superiore a una condizione di “normalità”. La lesione precancerosa è pertanto un’anomalia tissutale e/o cellulare che può evolvere verso una neoplasia come conseguenza di una serie di eventi a carico della popolazione cellulare sottoposta a uno stimolo oncogeno.
Epidemiologia
L’Organizzazione Mondiale della Sanità (OMS ha reso noto che nell’anno 1992 i tumori maligni della testa e del collo rappresentano, a livello mondiale, circa il 10% dei tumori maligni negli uomini e il 4% nelle donne. Tuttavia, le variazioni nella loro incidenza e mortalità sono molto marcate, con i tassi più elevati in India (1) e Francia settentrionale. In Italia, nei primi anni Novanta, si stima che i nuovi casi di tumore maligno del cavo orale e faringe siano stati all’anno circa 4600 negli uomini e 1300 nelle donne. Le cifre corrispondenti per carcinoma della laringe sono state 5000 negli uomini e 300 nelle donne. In Italia i tassi di incidenza sono più elevati nelle regioni settentrionali rispetto a quelle centromeridionali e insulari sia per il carcinoma del cavo orale e della faringe (di circa tre volte) sia per quello della laringe (di circa due volte).
A livello epidemiologico non è facile distinguere accuratamente le differenti sedi del tumore maligno del cavo orale (lingua, ghiandole salivari, gengive, pavimento della bocca e palato) e della faringe (oro-faringe, rino-faringe e ipo-faringe). I tumori maligni del cavo orale sono all’anno circa 8,2 per 100.000 negli uomini e 2,8 nelle donne, cioè, rispettivamente, il 25% e il 53% del totale della testa e collo. Per la faringe (rino-faringe compresa) i tassi sono 7,5 per 100.000 negli uomini e 1,5 nelle donne (con un eccesso maschile superiore di quanto osservato per il cavo orale). La massima differenza tra i due sessi si conferma per il carcinoma della laringe (19,8 per 100.000 negli uomini e 1,5 nelle donne). I tumori maligni della lingua e del resto della bocca all’incirca si equivalgono, mentre i tumori maligni dell’oro-faringe sono circa una volta e mezzo più frequenti di quelli dell’ipofaringe. Il carcinoma della laringe è più frequente di quello del cavo orale e della faringe, ma a causa di tendenze opposte negli ultimi vent’anni (in discesa il primo, in crescita i secondi) tale differenza è in diminuzione (2).
Localizzazione
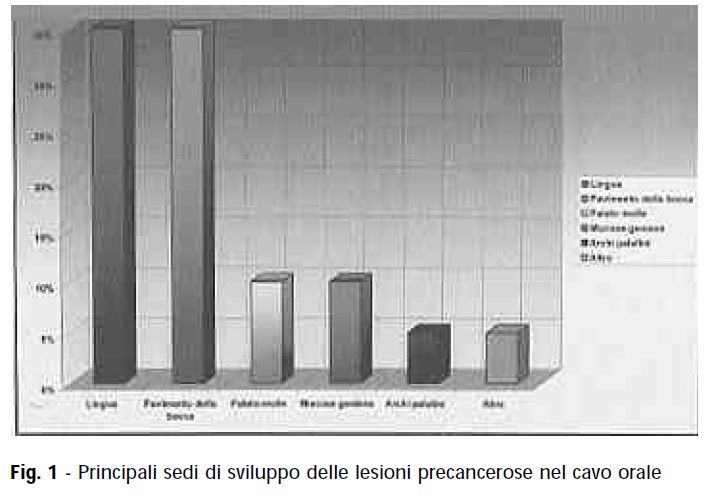
Le sedi maggiormente interessate dal carcinoma orale vengono rappresentati nel grafico di figura 1 (3).
Nell’arco della vita, la cellula va incontro a una serie di cambiamenti adattativi, rappresentati da una crescita e una possibile differenziazione sia degli elementi cellulari che dei tessuti. Gli elementi e gli apparati cellulari sono in grado di sintetizzare nuove proteine, regolare la presenza o l’assenza di specifici recettori di membrana, di modificare l’espressione genica e infine controllare e programmare la propria morte, processo definito di apoptosi.
Il processo di cancerogenesi, cioè nel passaggio da cellula normale a cellula neoplastica, nasce dall’alterazione di uno o più di questi sistemi e non è caratterizzato da un susseguirsi di eventi eclatanti e ben distinti tra di loro, ma è segnato solitamente da una velata progressione, a più stadi in cui il passaggio da self a non self, da normale a patologico non è facilmente evidenziabile. La degenerazione delle lesioni precancerose, può indurre la comparsa del carcinoma squamocellulare.
La prognosi dei pazienti affetti da carcinoma squamocellulare del cavo orale o più genericamente della testa e del collo non è significativamente migliorata negli ultimi anni nonostante il potenziamento dei mezzi diagnostici, degli approcci terapeutici e delle campagne di prevenzione primaria. Tale insuccesso clinico deriva essenzialmente dalla marcata eterogeneità del comportamento biologico di questi tumori, conseguente all’accumulo, da parte di un clone cellulare, di mutazioni geniche multiple, frequentemente diverse da tumore a tumore. Inoltre, la mancanza di un approccio diagnostico-terapeutico corretto e il ritardo nel riconoscimento delle lesioni possono influire di molto sugli stadi prognostici e le possibilità di sopravvivenza.
La cancerogenesi
La mucosa orale è formata da un epitelio squamoso stratificato che poggia sulla lamina propria e sulla sottomucosa. L’epitelio consiste di uno strato basale, di uno strato spinoso, di uno strato granuloso e di uno strato esterno corneificato. La mucosa orale si divide in mucosa di rivestimento meno cheratinizzata (versante vestibolare delle labbra, mucosa vestibolare, pavimento orale, ventre linguale e palato molle) e mucosa masticatoria più cheratinizzata (bordo vermiglio delle labbra, gengiva, dorso linguale e palato duro).
I principali fattori irritativi legati alla precancerosi orali possono essere sia di tipo meccanico o chimico sia di origine esogena che endogena (tabella I).

Tra i fattori meccanici possiamo annoverare sollecitazioni meccaniche che possono essere causate da protesi e/o restauri incongrui, elementi dentari fratturati o da disgnazie. Il tessuto cronicamente sollecitato, nel tempo tende a reagire a questo stimolo. La risposta della mucosa può interessare l’epitelio (da una condizione di semplice ipercheratosi a una forma di displa- sia più o meno grave), il connetti- vo (fibromatosi) o l’epitelio e il connettivo.
I fattori irritativi di tipo chimico sono rappresentati dai prodotti di combustione del tabacco e da prodotti del catabolismo di bevande alcoliche. In quest’ultima condizione non è infrequente che vi sia una concomitanza con una epatopatia cronica progressiva alcolica. Il fumo rappresenta di gran lunga la causa principale delle neoplasie maligne della testa e del collo dei paesi sviluppati.
Il rischio di sviluppare tumori maligni in soggetti che fumano meno di 15 sigarette al giorno è di 3-4 volte aumentato rispetto ai non fumatori, mentre per livelli di fumo maggiori sale da 9-10 volte. Tale rischio, tuttavia, declina sostanzialmente circa dieci anni dopo la cessazione del fumo. Per i tumori maligni del cavo orale l’associazione è forte oltre che con il consumo di sigarette, con l’uso di pipa e sigari (4, 5), nonché nelle aree dell’Asia dove questa abitudine è diffusa, con la masticazione di noce e foglie di betel. Pertanto, questi fattori irritativi, isolatamente o più frequentemente in sinergismo, sono i responsabili di quel processo che viene definito adattamento cellulare. L’adattamento cellulare a uno o più stimoli può indurre un danno cellulare che può evolvere verso un lungo adattamento cellulare, una possibile evoluzione verso la morte programmata della cellula (apoptosi), oppure verso una degenerazione progressiva di tipo irreversibile.
Le lesioni orali possono progredire in direzione di una forma maligna attraverso stadi intermedi rappresentati dall’ipercheratosi, iper-ortocheratosi, iper-paracheratosi, iper orto-para-charatosi, stadi di metaplasia, di displasia caratterizzata da diversi gradi, fino alla vera anaplasia che induce la formazione del carcinoma in situ.
Displasia
Il termine displasia indica la crescita disorganizzata degli elementi cellulari. Possono essere descritti vari gradi di displasia in presenza di alterazioni epiteliali lievi, moderate e gravi (tab. 2). La displasia è suddivisa in tre gradi, perché nel concetto di displasia c’è sempre la possibilità che il quadro patologico possa scomparire e ritornare a uno stato fisiologico, soprattutto se viene a cessare lo stimolo promuovente. Le displasie epiteliali della mucosa orale possono essere identificate anche con il termine di Oral Intraepithelial Neoplasia (OIN), che prevede tre gradi differenziativi dal punto di vista istologico 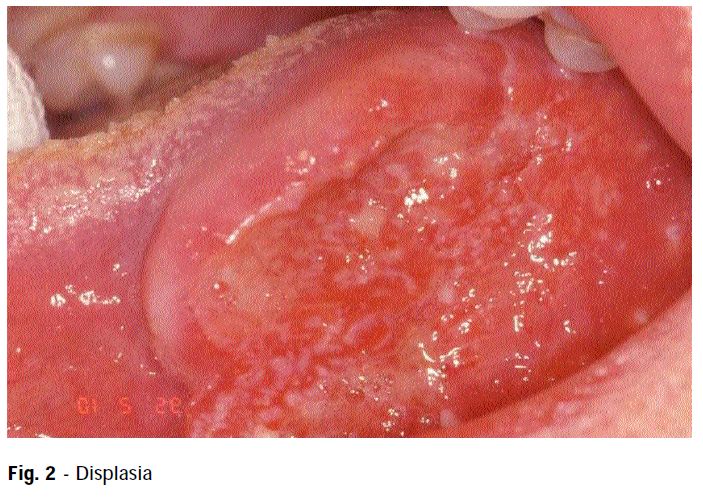 riportati nella tabella II. La determinazione del grado di displasia è un’operazione di tipo soggettivo e serve a indicare che le alterazioni non sono abbastanza severe da permettere una diagnosi di neoplasia.
riportati nella tabella II. La determinazione del grado di displasia è un’operazione di tipo soggettivo e serve a indicare che le alterazioni non sono abbastanza severe da permettere una diagnosi di neoplasia.
Le caratteristiche specifiche della displasia comprendono:
a) interdigitazione epiteliale a goccia,
b) iperplasia dello strato basale,
c) stratificazione irregolare,
d) figure mitotiche aumentate di numero di aspetto anomalo,
e) presenza nello strato spinoso, di singoli elementi o gruppi di cellule cheratinizzate,
f ) alterazioni del rapporto nucleo/citoplasma,
g) perdita o diminuzione dell’adesione intercellulare,
h) ipercromatismo cellulare (6) (tabella III).

Carcinoma squamocellulare
 La degenerazione delle lesioni pre-cancerose induce la comparsa del carcinoma squamocellulare. La prognosi dei pazienti affetti da carcinoma squamocellulare della testa e del collo non è significativamente migliorata negli ultimi anni nonostante il potenziamento dei mezzi diagnostici e degli approcci terapeutici. Tale insuccesso clinico deriva essenzialmente dalla marcata eterogeneità del comportamento biologico di questi tumori, conseguente all’accumulo, da parte di un clone cellulare, di mutazioni geniche multiple, frequentemente diverse da tumore a tumore. È pertanto l’effetto combinato, non solo sommatorio, delle diverse e molteplici alterazioni geniche che conferisce al clone tumorale le specifiche proprietà biologiche, mentre pressoché nessuna alterazione singolarmente ha un effetto preponderante nel determinare tali proprietà. La ricerca e lo studio di marker biologici fenotipici e funzionali con prospettive clinico-applicative si è posta come scopo l’acquisizione di informazioni di base per meglio conoscere e comprendere la storia naturale preclinica e clinica del tumore, senza trascurare gli aspetti applicativi relativi all’identificazione di indicatori prognostici e di indicatori di risposta ai diversi tipi di trattamento locale o sistemico.
La degenerazione delle lesioni pre-cancerose induce la comparsa del carcinoma squamocellulare. La prognosi dei pazienti affetti da carcinoma squamocellulare della testa e del collo non è significativamente migliorata negli ultimi anni nonostante il potenziamento dei mezzi diagnostici e degli approcci terapeutici. Tale insuccesso clinico deriva essenzialmente dalla marcata eterogeneità del comportamento biologico di questi tumori, conseguente all’accumulo, da parte di un clone cellulare, di mutazioni geniche multiple, frequentemente diverse da tumore a tumore. È pertanto l’effetto combinato, non solo sommatorio, delle diverse e molteplici alterazioni geniche che conferisce al clone tumorale le specifiche proprietà biologiche, mentre pressoché nessuna alterazione singolarmente ha un effetto preponderante nel determinare tali proprietà. La ricerca e lo studio di marker biologici fenotipici e funzionali con prospettive clinico-applicative si è posta come scopo l’acquisizione di informazioni di base per meglio conoscere e comprendere la storia naturale preclinica e clinica del tumore, senza trascurare gli aspetti applicativi relativi all’identificazione di indicatori prognostici e di indicatori di risposta ai diversi tipi di trattamento locale o sistemico.
Durante successive moltiplicazioni l’instabilità genetica delle cellule tumorali si traduce in anomalie qualitative e quantitative dell’assetto cromosomico, con variazioni del contenuto totale di DNA nucleare. Il gene onco-soppressore p53 è il più diffusamente mutato nei tumori umani e anche il più studiato per il suo supposto coinvolgimento in diverse funzioni tra cui la regolazione del ciclo cellulare e il processo di morte programmata o apoptosi. Dai diversi Autori, viene riportata nei carcinomi squamocellulari della testa e del collo un’elevata frequenza di mutazioni del gene (60-70%) e di overespressione della proteina (5080%). Inoltre, sia le mutazioni che l’iper-espressione compaiono precocemente nelle lesioni precancerose (7).
Stati di precancerosi
 Buona parte dei carcinomi del cavo orale insorge su manifestazioni già note come stati precancerosi (leucoplachie, eritroplasia, lichen, fibrosi sottomucosa). Approssimativamente tale quota può essere stimata fra il 15 e il 40%. La degenerazione può avvenire anche dopo molti anni (15-30) ed è tanto più probabile quanto minore è l’età di comparsa (tabella V).
Buona parte dei carcinomi del cavo orale insorge su manifestazioni già note come stati precancerosi (leucoplachie, eritroplasia, lichen, fibrosi sottomucosa). Approssimativamente tale quota può essere stimata fra il 15 e il 40%. La degenerazione può avvenire anche dopo molti anni (15-30) ed è tanto più probabile quanto minore è l’età di comparsa (tabella V).
Le manifestazioni cliniche più comuni di stati di precancerosi delle mucose orali insorgono, più comunemente, come una variazione di colore delle mucose. Distinguiamo lesioni bianche, rosse e bianco-rosse.
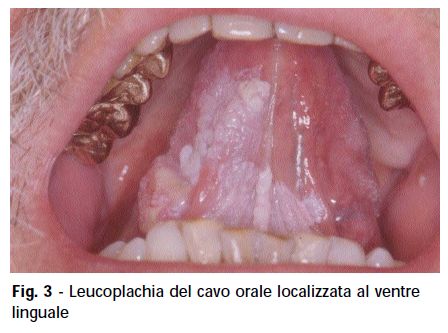
La leucoplachia del cavo orale (fig. 3) è una lesione che non può essere attribuita né clinicamente né istologicamente ad altra malattia. È una lesione bianca non raschiabile che colpisce le mucose orali, ma in letteratura sono descritte lesioni simili anche a livello delle regioni anali e genitali.
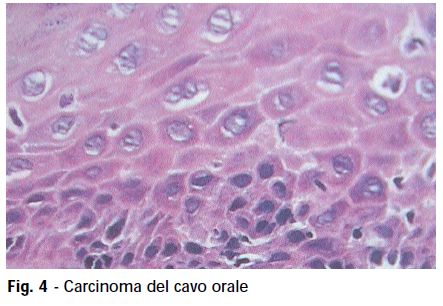
Istologicamente può presentarsi come una semplice ipercheratosi, ma può presentare gradi di displasia con diversi livelli di gravità nascondendo lesioni preinvasive nel 24% dei casi, come neoplasie intraepiteliali, e persino il Carcinoma del Cavo Orale CCO (fig. 4). Dal punto di vista biologico e della storia naturale, il CCO presenta tre tipologie diverse:
1. vegetante, esofitico che si accresce verso il cavo orale, con andamento biologico più mite, più facilmente eradicabile, con rare recidive e metastasi;
2. ulcerato, infiltrante profondamente i tessuti, biologicamente più maligno e, a seconda delle sedi, facilmente diffusibile per via linfatica ed ematica;
3. nodulare o a placca, anch’essi in-vasivi, con aspetti macroscopici molto simili a quelli della leucoplachia, dell’eritroleucoplachia o dell’eritroplasia.
Questo terzo tipo di CCO è certamente il più ambiguo e talora disconosciuto, mentre per gli altri due tipi di neoplasia la diagnosi di neoplasia è frequentemente avanzata.
Per tutte queste ragioni è fondamentale svolgere un’appropriata diagnosi precoce del CCO, sia nella forma a placca che in quelle iniziali, ma anche soprattutto quello di favorire il possibile discernimento di quelle leucoplachie e/o delle malattie precancerose del cavo orale e che in qualche modo e in misura diversa precorrono il CCO.
Le sedi più comunemente colpite sono la mucosa geniena, la commissura retrolabiale, le mucose gengivali e la lingua.
La diagnosi differenziale va posta con le altre più comuni lesioni bianche che colpiscono le mucose della cavità orale sia a carattere infettivo, a eziologia fungina, o virale (vedi leucoplachia villosa), sia a carattere auto-immunitario (lichen orale) (8).
Tuttavia, alcune forme di lichen planus orale, in particolare nelle forme atrofico-erosive e le stesse lesioni lichenoidi del cavo orale sembrano essere maggiormente implicate in evoluzioni in senso neoplastico (9).
L’eritroplachia o eritroplasia di Queyrat si presenta come un’area eritematosa, indistinta e di aspetto vellutato. È possibile che vi sia concomitanza con aree biancastre. In questo caso la lesione è definibile eritro-leucoplachia. Il potenziale neoplastico risulta nettamente superiore alla leucoplachia tanto che viene inquadrata come una precancerosi obbligatoria.
Vengono classificate anche come lesioni potenzialmente maligne la stomatite nicotinica e la cheilite attinica (14). Quadri clinici legati a candidosi croniche, infezioni virali in particolare da Human Papilloma Virus (HPV) (10), o a sindromi sistemiche come nell’AIDS, nella sindrome di Plummer-Vinson (o disfagia sideropenica) e nelle distrofie mucose in pazienti epatopatici ed etilisti sembrano predisporre maggiormente all’instaurarsi di carcinomi mucosi.
Aspetti diagnostici nelle precancerosi orali
 Affinché si possa riconoscere precocemente una lesione potenzialmente maligna, il clinico deve essere in grado di adottare un algoritmo clinico-decisionale e diagnostico, caratterizzato da più stadi, che possa essere utile sia al riconoscimento delle lesioni precancerosi stesse, sia a escludere altre manifestazioni patologiche con aspetti clinici simili (tabella V). Le metodiche di indagine sono diverse e immediate e nello stesso tempo fondamentali per una diagnosi che potrebbe rivelarsi vitale.
Affinché si possa riconoscere precocemente una lesione potenzialmente maligna, il clinico deve essere in grado di adottare un algoritmo clinico-decisionale e diagnostico, caratterizzato da più stadi, che possa essere utile sia al riconoscimento delle lesioni precancerosi stesse, sia a escludere altre manifestazioni patologiche con aspetti clinici simili (tabella V). Le metodiche di indagine sono diverse e immediate e nello stesso tempo fondamentali per una diagnosi che potrebbe rivelarsi vitale.
La raccolta dettagliata dei dati anamnestici del paziente, l’esame obbiettivo locale (EOL) più una serie di esami collaterali molto importanti come l’esame citologico e isto-morfologico, possono essere considerati degli strumenti che faciliteranno la formulazione di una diagnosi appropriata da parte dell’odontoiatra. Solo dopo aver completato l’esame obiettivo e a integrazione di esso, si ricorre a più complessi mezzi di indagine utili per porre una diagnosi.
L’esame citologico ci consente di analizzare le tipologie di cellule presenti sulla superficie della lesione. Il prelievo viene effettuato attraverso uno spazzolino da paptest, strisciato su un vetrino sterile e poi fissato. Non può essere considerato un esame sensibile poiché possono essere omesse eventuali atipie presenti negli strati più profondi della lesione.
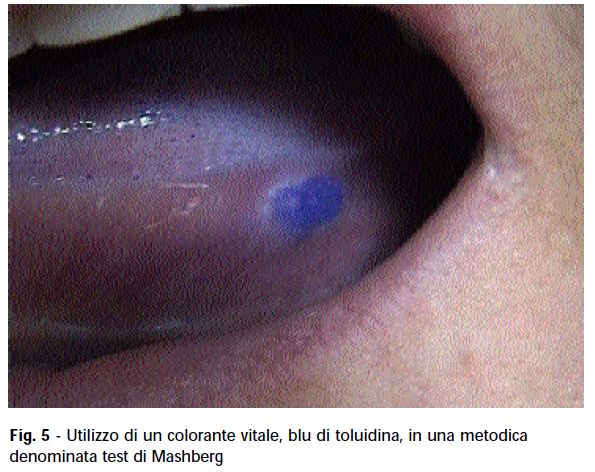
L’utilizzo di coloranti vitali con il blu di toluidina è una metodica immediata denominata test di Mashberg (fig. 5). Il blu di toluidina è un colorante vitale affine per gli acidi nucleici che permette l’identificazione di aree di maggior rischio. Il procedimento consiste in uno sciacquo prima con acqua, in seguito con una soluzione di acido acetico al 3% per quaranta secondi, quindi si applica con un pennello la colorazione vitale sul sito di indagine. Il paziente esegue un ulteriore sciacquo in mezzo bicchiere d’acqua con un terzo di blu di toluidina.
La positività al blu di toluidina è indice di una possibile atipia cellulare (11-14).
Nei siti rilevati dalla colorazione l’odontoiatra potrà eseguire una biopsia in modo tale che il reperto anatomico potrà essere valutato in laboratorio.
 L’esame istopatologico può dare conferma all’ipotesi diagnostica. La biopsia può essere incisionale, quindi viene rilevata solo una piccola parte della lesione, o escissionale dove è possibile eliminare in toto la lesione.
L’esame istopatologico può dare conferma all’ipotesi diagnostica. La biopsia può essere incisionale, quindi viene rilevata solo una piccola parte della lesione, o escissionale dove è possibile eliminare in toto la lesione.
Lo strumentario indispensabile comprende: forbici, bisturi con lama del 15 o 12, bisturi circolari monouso definiti punch, con diametri di 0,4-0,6-0,8, può essere utile la curetta di Stiefel utilizzata in dermatologia, tale strumento mostra un margine piatto e smussato, da utilizzarsi per lesioni su superfici linguali, pinzetta anatomica, strumenti rotanti per le biopsie ossee o pinze ossifere, contenitori con formalina tamponata al 4%. Le suture devono essere in seta, non riassorbibili, da rimuovere circa una settimana dopo. L’anestesia va effettuata senza vasocostrittore, tranne nei casi di copioso sanguinamento.
Il reperto anatomico dovrà essere conservato in formalina al 4% (aldeide formica) in proporzioni di due terzi di acqua e un terzo di formalina. La formalina blocca il metabolismo dei tessuti e non altera le caratteristiche istologiche. La metodica più esatta da eseguire sarebbe riuscire a unire il connettivo della lesione su una carta assorbente, in tal modo il patologo è in condizione di poter valutare l’epitelio. Come norma, qualunque lesione sospetta che non regredisce entro quindici giorni dovrebbe essere analizzata in laboratorio, poiché il ciclo vitale dei cheratinociti che costituiscono la parte più superficiale dell’epitelio avviene in questo tempo.
È importante raccogliere un’anamnesi approfondita del paziente, ricostruire attraverso la sua storia le sedi iniziali e secondarie, le modalità di presentazione clinica e l’evoluzione delle lesioni e cercarne conferma nella visita medica, l’assunzione di eventuali farmaci e la concomitanza di patologie sistemiche in atto.
Conclusioni
La diagnosi precoce delle lesioni precancerose che possono evolvere verso un carcinoma del cavo orale è un elemento prezioso della responsabilità etico professionale dell’operatore. La disinformazione della popolazione a riguardo dei presidi preventivi dei vari fattori di rischio, il mancato riconoscimento delle displasie epiteliali e del carcinoma del cavo orale in fase iniziale da parte degli operatori e specialisti unitamente al ritardo con cui si giunge alla diagnosi, non concedono grandi speranze di successi terapeutici
Per tutte queste ragioni appare evidente come, ancora oggi, l’obbiettivo di maggior interesse e assolutamente indispensabile sia quello di formulare una corretta diagnosi precoce delle forme displastiche e dello stesso carcinoma delle mucose orali. In questo tentativo l’igienista dentale e lo stesso odontoiatra giocano un ruolo clinico preventivo di primaria importanza. L’osservanza di precisi criteri semeiologici è, a nostro parere, di notevole ausilio per facilitare l’orientamento diagnostico di tutte quelle forme di precancerosi orali e delle stesse forme carcinomatose. Le misure terapeutiche preventive che tendono a diminuire i fattori carcinogenetici, in grado di rappresentare uno stimolo cronico, sono misure sufficienti nei casi con ridotto rischio di degenerazione:
• la bonifica orale di traumi (micro traumi da protesi incongrue, radici, bordi taglienti, abitudini viziate) e flogosi locali (carenza di igiene, infezioni batteriche micotiche);
• l’eliminazione dei fattori generali di rischio (fumo, alcol, spezie, carenza di vitamine e di oligoelementi, allergie alimentari, stress, diabete, epatopatia);
• l’identificazione e la terapia di patologie sistemiche con manifestazioni orali precancerose.
L’asportazione chirurgica è sempre consigliata, ma può essere dilazionata in presenza di lesioni a basso rischio su richiesta del paziente; è, invece, necessaria nei casi suggestivi di elevato potenziale di degenerazione della lesione con caratteri clinici di malignità o referto istopatologico di displasia in grado elevato. L’assunzione di antiossidanti (15) (vitamina A ed E, retinoidi, selenio...) favorisce la regressione nella leucoplachia e delle lesioni precancerose della mucosa orale, prevenendo la loro evoluzione verso il carcinoma del cavo orale, ma il trattamento di predilezione per i casi è sempre quello chirurgico, recentemente affiancato dalla crioe laser-terapia, dall’uso topico di pomata contenente 5fluorouracile,dall’infiltrazione con bleomicina e dalla somministrazione di beta-interferone.
L’applicazione di talune direttive anatomo-cliniche dovrebbero portare a una selezione dei pazienti a rischio o con lesioni dubbie, che dovranno essere sottoposti successivamente ad accertamenti istologici e a ulteriori indagini clinicodiagnostiche. In questo modo è auspicabile una riduzione sensibi le delle forme neoplastiche e precancerose, all’opportunità di una terapia adeguata e tempestiva e a un calo dei tassi di mortalità.
Riassunto
Ancora oggi la diagnosi precoce delle lesioni precancerose, che potrebbero evolvere verso potenziali neoplasie, è la più importante forma di prevenzione nei confronti di tali lesioni.
La figura dell’igienista dentale può essere compresa tra coloro che per primi vengono a contatto diretto con il paziente e che quindi possono dare un fondamentale contributo nella diagnosi delle lesioni precancerose del cavo orale potenzialmente maligne.
La conoscenza e l’utilizzo di particolari manovre profilattiche possono essere fondamentali nella diagnosi di lesioni che possono essere ritenute sospette.
Abbiamo voluto ricordare brevemente quali sono le cause e le trasformazioni istopatologiche che le cellule subiscono nell’evoluzione neoplastica e la fisiologica composizione a livello istologico della mucosa orale.
Le manovre profilattiche di maggior rilevanza vengono descritte nei loro aspetti fondamentali.
La conoscenza di tali metodiche di indagine deve essere percepita come obbligo morale nei confronti della persona come uomo e non come paziente.
Parole chiave
Diagnosi precoce
Displasia
Biopsia
Tumore bocca
Abstract
The role of the dental hygienist in precancerous lesions prevention. Today it’s important an early diagnosis about precancerous lesions, because they could have a development towards malignant injuries. Usually, the dental hygienist has a first contact with a patient, in this way he gives an important contribute for checking of precancerous lesions.
The knowledge and an appropriate use of peculiar methodologies can be extremely significant for the diagnosis of suspicious lesions. The Authors remind, in a few words, some reasons and histological mutations, sometimes they produce damages and changes among different cells and promote a malignant transformation of them. In a simple way, the Authors would explain some methods to have a first diagnosis of oral lesions. The knowledge of these manners is an important moral obligation towards people.
Key words
Early screening
Dysplasia
Biopsy
Bibliografia
1. Sankaranarayanan R. Oral Cancer in India: an epidemiologic and clinical review. Oral Surg Oral Med Oral Pathol 1990; 69: 325-30.
2. Kaugars GE, Burns JC, Gunsolley JC. Epithelial dysplasia of the oral cavity and lips. Cancer 1988; 62(10): 2166-70.
3. Anastasia M. Chimica di base per le scienze della vita. Milano: Antonio Delfino, 1997.
4. Baric JM, Alman JE, Feldman RS et al. Influence of cigarette, pipe and cigar smoking on removable partial dentures, and age on oral leukoplakia. Oral Surg 1982; 54: 424-9.
5. Grady P, Greene J, Daniels TE et al. Oral mucosal lesions found in smokeless tobacco users. J Am Dent Ass 1990; 121: 117-23.
6. Regezi JA, Sciubba JJ. Oral Patology, III ed. Milano: Antonio Delfino, 1999.
7. Gopalakrisnan R, Weghorst CM, Lehman TA et al. Mutated and wildtype-p53 expression and HPV integration in proliferative verrucous leukoplakia and oral squamous cell carcinoma. Oral Surg Oral Med Oral Pathol 1997; 83: 471-7.
8. Dekker NP, Lozada-Nur F, Lagenauer LA et al. Apoptosis-associated markers in oral lichen planus. J Oral Pathol Med 1997; 26: 170-5.
9. Barnard NA, Scully C, Everson JW et al. Oral cancer development in patients with oral lichen planus. J Oral Pathol Med 1993; 22: 421-4.
10. Watts S, Brewer Erin, Fry T. Human papillomavirus DNA types in squamous cell carcinomas of the head and neck. Oral Surg Oral Med Oral Pathol 1991; 71: 701-7.
11. Epstein JB, Scully C, Spinelli J. Toluidine blue and Lugol’s iodine application in the assessment of oral malignant disease and lesion at risk of malignancy. J Oral Pathol Med 1992; 21(4): 160-3.
12. Onofre MA, Sposto MR, Navarro CM. Reability of toluidine blue application in the detection of oral epithelial dysplasia and in situ and invasive squamous cell carcinomas. Oral Surg Oral Med Oral Pathol Radiol Endod 2001;
13. Miller RL, Simms BW, Gould AR. Toluidine blue staining for detection of oral premalignant lesions and carcinomas. J Oral Pathol 1988; 17(2): 73-8.
14. Silverman S Jr, Migliorati C, Barbosa J. Toluidine blue staining in the detection of oral precancerous and malignant lesions. Oral Surg Oral Med Oral Pathol 1984; 57(4): 379-82.
15. Kaugars GE, Silverman S, Lovas JGL et al. Use of antioxidant supplements in the treatment of human oral leucoplakia. Oral Surg 1996; 81: 5-14.